Tercer Milenio

En colaboración con ITA
Ciencia que alimenta
¿Por qué nos gusta tanto la cerveza muy fría (y, por el contrario, el brandy incluso caliente)?
La explicación radica en los agregados que forman las moléculas de etanol y agua en el seno de la bebida.

Lo de que la cerveza nos gusta bien fría no es tanto una verdad absoluta, porque hay muchos tipos de cervezas, cada uno con sus propias peculiaridades organolépticas y su temperatura idónea de consumo; y porque cada persona es un mundo y, de igual modo que hay sujetos a los que les pierde el bocadillo de nocilla con chorizo, no se puede descartar que haya quien disfrute de una cerveza tibia o un wiski recién sacado del congelador. Pero sí un principio o axioma general atendiendo a los gustos de una 'inmensa minoría'.
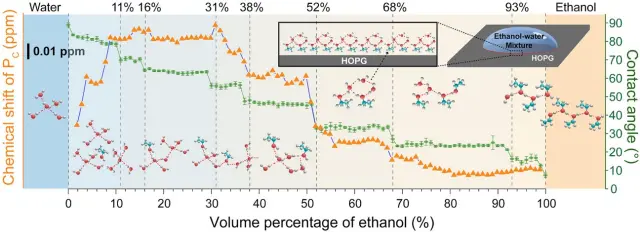
Pero ya sea realidad absoluta, principio general o mera opinión subjetiva, personal e intransferible, lo importante a efectos de la pertinencia de este texto es que un reciente estudio postula una explicación plausible al respecto: explicación que parte de la estructura interna de las mezclas de etanol y agua, que distan mucho de comportarse como disoluciones ideales, en el sentido de que cada molécula etanólica estaría rodeada de moléculas de agua que la integrarían en su seno.
Por el contrario, según concluye el estudio, la mayor parte de las moléculas de etanol se encuentran formando parte de clústeres o agregados a base de moléculas de etanol y agua. Agregados sostenidos por enlaces de (puente de) hidrógeno y que fundamentalmente son de dos tipos: piramidales o tetraédricos -con las moléculas que los conforman dispuestas en los vértices de una pirámide tetraédrica- y lineales. Los primeros integrados por moléculas de agua a las que se engancha una molécula de etanol. Y los segundos, en los que las moléculas de etanol y agua se alternan conformando una cadena.
Una composición relativa que se explica fácilmente: la disposición tetraédrica implica un mayor orden interno, esto es, exige que las moléculas que la integran se dispongan en unas posiciones más específicas.
A las poco 'voluminosas' moléculas de agua esto no les resulta difícil. Pero en el caso del etanol, el grupo alquilo es más voluminoso y constituye un estorbo, por lo que integrar a más de una es problemático. Por el contrario, en la disposición lineal, los grupos alquilo del etanol se ubican perpendicularmente a la dirección de la cadena y no interfieren tanto en su formación.
Dicho lo cual, es fácil de entender por qué y cómo la distribución o relación entre un tipo y otro de agregados en una bebida alcohólica depende, en primer lugar, de la concentración de alcohol (o, si se prefiere, de la graduación alcohólica de la bebida). Conforme esta aumenta, la proporción de agregados linéales hace lo propio, de tal modo que esta domina en las bebidas con más graduación (como el wiski, el brandy y demás destilados), en tanto que en las bebidas más 'light' como la cerveza o el vino blanco prevalecen los agregados piramidales.
Ese sabor refrescante
Más relevante aún es que estos agregados no solo se diferencian en su estructura interna, sino también en su sabor: los agregados piramidales tienen un sabor más refrescante, en tanto que los lineales tienen un sabor más alcohólico. Algo que parece bastante lógico atendiendo a su composición relativa: dado que en los piramidales predominan las moléculas de agua, lo normal es que sepan más frescas. Y que los lineales, con más protagonismo de moléculas de etanol, sepan más alcohol.
Pero hasta aquí lo único que hemos aclarado es por qué las bebidas con más graduación alcohólica saben como saben -y queman como queman-, lo cual ya se explica suficientemente bien por sí mismo.
¿Y la temperatura?
Pero ¿qué hay de la temperatura? A eso vamos ahora: resulta que el aumento de la temperatura incrementa la proporción de agregados lineales frente a los piramidales. Algo de nuevo fácil de entender si tenemos en cuenta que a mayor temperatura, más energía interna tienen las moléculas, más se agitan y mueven, y más difícil es mantener una estructura ordenada y rígida, como la tetraédrica, frente a la lineal, más flexible y que permite más movilidad.
Claro que, visto así, parecería que la cerveza debería saber más a alcohol tibia y más fresca cuanto más fría esté. O, dicho de otro modo: que nos debería gustar más a temperatura ambiente que muy fría -o eso, o es que en realidad no te gusta la cerveza y lo que quieres es un refresco; y en la mayoría de los casos no es el ídem-.
La explicación a esta aparente contradicción, tal como el estudio se ha encargado de demostrar, es que en las bebidas con una baja graduación (como la cerveza), a menor temperatura también aumenta la proporción de agregados lineales -lo que potencia su sabor a alcohol frente a la cerveza a temperatura ambiente-. Es más, se maximiza la presencia de ambos tipos de clústeres. Lo que hace que la cerveza bien fría combine el sabor refrescante de unos con el gusto alcohólico de los otros. Un combo insuperable.
Una explicación de cosecha propia
Aunque el estudio no explica por qué en las bebidas de poca graduación a menor temperatura se maximiza la presencia de ambos tipos de agregados, podemos intentar orquestar una explicación convincente: sabemos que el agua congela a 0ºC y que el hielo presenta una estructura cristalina con las moléculas ordenadas en una red tridimensional y dispuestas entre sí de un modo muy similar a como se encuentran en esos clústeres tetraédricos.
También sabemos que esta estructura es la clave para que el hielo sea menos denso que el agua. Y que el agua alcanza su máximo de densidad a 4ºC. A partir de ese punto, conforme disminuye la temperatura, la densidad también lo hace.
Lo que indica que el agua comienza a 'precongelarse' conforme su temperatura se aproxima a la de congelación, por decirlo de algún modo: la mayoría de las moléculas de agua comenzarán a ordenarse para convertirse en hielo conformando agregados tetraédricos en los que ahora las moléculas de etanol ya no tienen cabida. Por lo que a estas no les queda otra que formar clústeres lineales.
-Ir al suplemento Tercer Milenio
Apúntate y recibe cada semana en tu correo la newsletter de ciencia




